PXT864
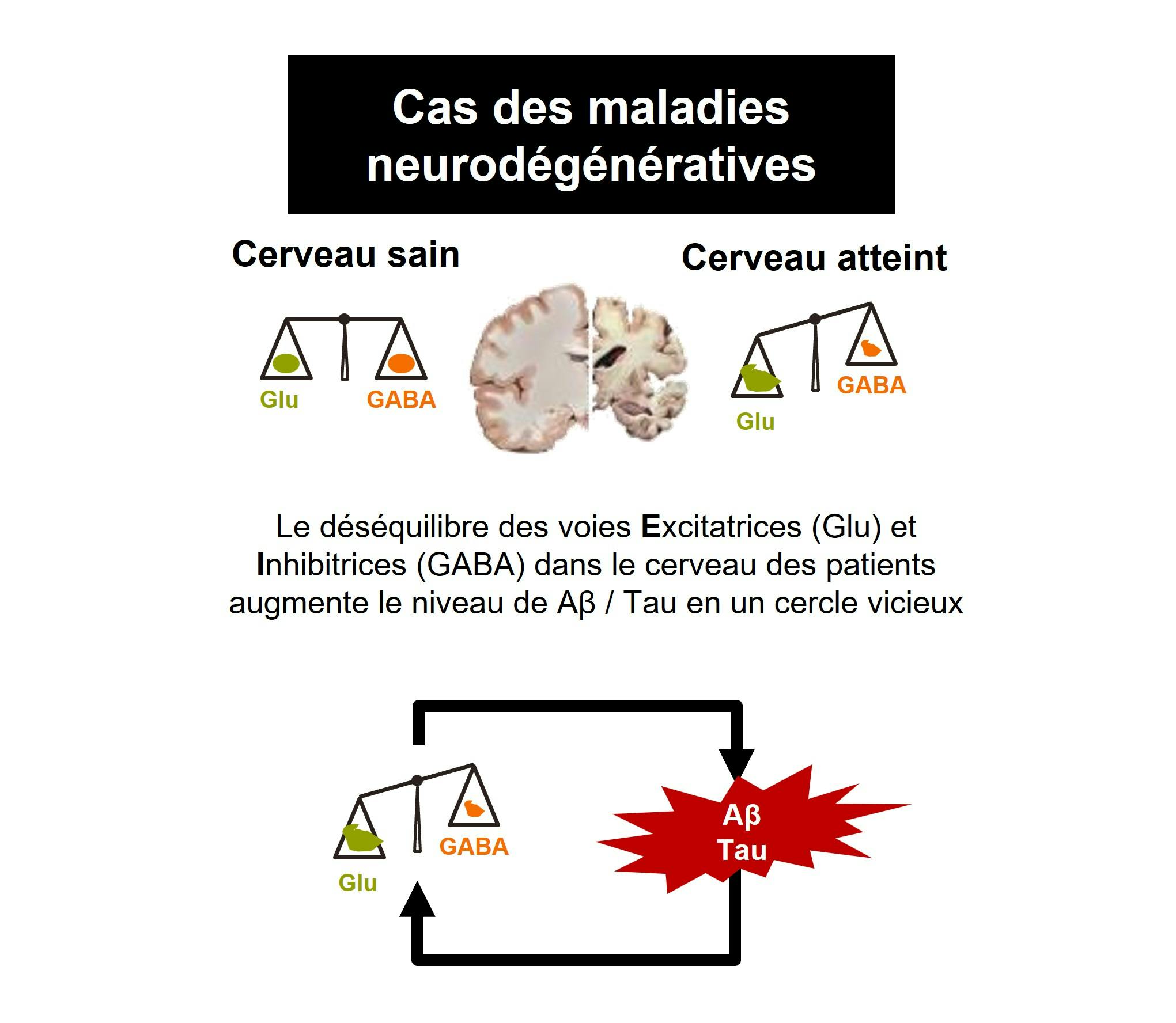
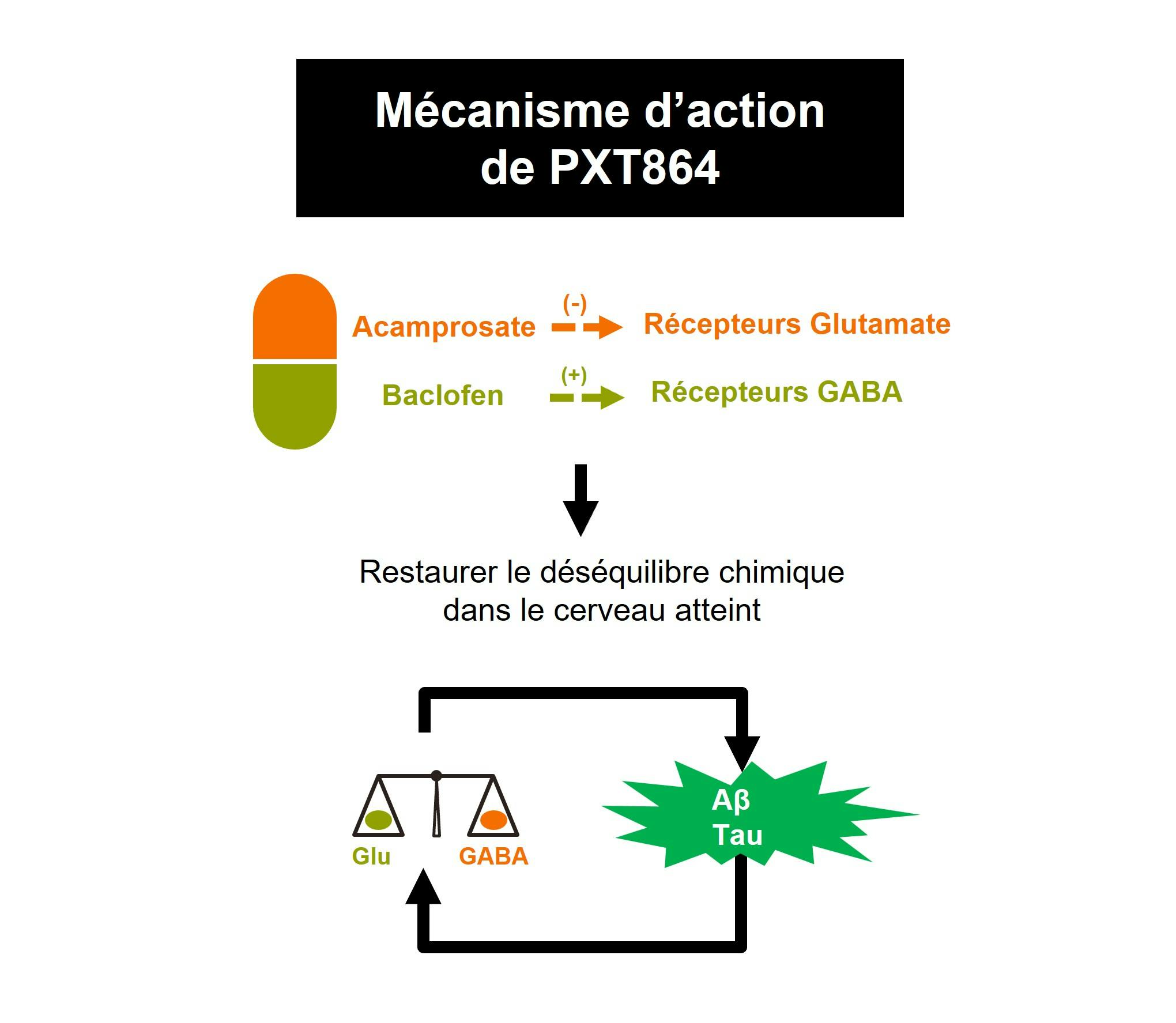
PXT864 est une nouvelle combinaison synergique à dose fixe de baclofène et d’acamprosate formulée sous forme de comprimé administré deux fois par jour. Le principal mécanisme d’action présumé de PXT864 dans les maladies neurodégénératives est de rétablir l’équilibre entre les voies excitatrices (activité du glutamate) et inhibitrices (activité de GABA). Cet équilibre est perturbé par des facteurs toxiques tels que les oligomères du peptide Aβ dans la maladie d’Alzheimer, notamment.
PXT864 s’est avéré sûr et bien toléré lors d’une étude de Phase 1 menée sur 24 volontaires sains.
L’indication la plus avancée de PXT864 est la maladie d’Alzheimer. Une deuxième étude de Phase 1 ; menée sur 20 volontaires sains, a permis d’obtenir des résultats préliminaires d’efficacité dans un modèle de démence induite par la scopolamine. En 2015, des résultats encourageants ont également été obtenus avec PXT864 dans un essai clinique de Phase 2a chez 45 patients à un stade précoce de la maladie d’Alzheimer.
En 2023, Pharnext a pourtant décider d’arrêter le développement de PXT864 dans la maladie d’Alzheimer malgré des résultats précliniques et cliniques encourageants car ils restaient insuffisants pour une exploitation commerciale.
Les caractéristiques génétiques, moléculaires et cellulaires communes entre la maladie d’Alzheimer et la Sclérose Latérale Amyotrophique (SLA) ont conduit Pharnext à étudier l’efficacité potentielle de PXT864 dans cette autre indication.
PXT864 a montré des résultats encourageants dans plusieurs modèles précliniques de la SLA (Boussicault et al. J Neurosci Res. 2020) :
- inhibition significative de la perte des jonctions neuromusculaires entre les cellules neuronales et musculaires ;
- protection du réseau neuronal ;
- synergie avec le riluzole et renforcement de son effet protecteur.
Sur la base des résultats de sécurité et de tolérance obtenus en essai de Phase 1, PXT864, seul ou en association avec des médicaments déjà approuvés dans le traitement de la SLA, est prêt à poursuivre son développement en essai clinique de Phase 2a.
La sclérose latérale amyotrophique (SLA) est une maladie neurodégénérative chronique orpheline qui se caractérise par une perte progressive des neurones moteurs centraux et périphériques, conduisant rapidement à un handicap majeur et finalement la mort. La SLA touche environ 400 000 personnes dans le monde.
Il n'existe actuellement aucune thérapie capable d'influer sur l'évolution de la SLA. Les seuls traitements autorisés sont le riluzole et l'eadaravone, mais leur efficacité est modeste et de courte durée. Ils ont un impact très limité sur l'espérance de vie et n'améliorent pas la qualité de vie.