PXT3003
La CMT1A est une neuropathie périphérique héréditaire démyélinisante qui se caractérise par une faiblesse et atrophie musculaire au niveau des bras et des jambes, provoquant des troubles moteurs progressifs et une perte sensorielle. La mutation génétique à l’origine de cette maladie est une duplication du gène PMP22, induisant une surexpression de la protéine PMP22 et l’incapacité des cellules de Schwann à produire une myéline normale (gaine des neurones). La gaine de myéline ainsi dégradée (structure et fonctionnalité) perturbe la conduction de l’influx nerveux au niveau des nerfs périphériques et provoque la dégradation des axones et l’atrophie musculaire.
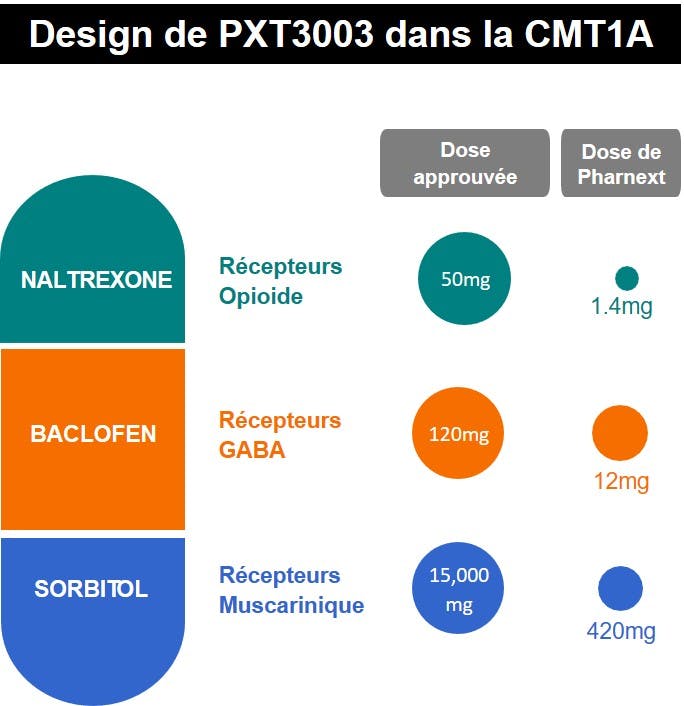
PXT3003 est une nouvelle combinaison synergique à dose fixe de baclofène, naltrexone et sorbitol formulée sous forme de solution buvable administrée deux fois par jour. Ces trois composants de PXT3003 ont été sélectionnés pour inhiber la surexpression de la protéine PMP22, et ainsi améliorer la conduction de l’influx nerveux des nerfs périphériques endommagés, élément majeur de la physiopathologie de cette maladie. PXT3003 pourrait également avoir un effet positif sur d'autres types cellulaires de l'unité motrice tels que l'axone (protection directe), les jonctions neuromusculaires ou les cellules musculaires.
En 2014, l'EMA et la FDA ont accordé le statut de médicament orphelin au PXT3003 pour le traitement de la CMT1A chez l'adulte. PXT3003 a également reçu la désignation « fast-track » de la FDA au premier trimestre 2019 et le statut de Médicament Innovant Prometteur (Promising Innovative Medicine status) de l’agence de santé britannique (MHRA : Medicine and Healthcare products Regulatory Agency).

PXT3003 a montré des résultats prometteurs et cohérents dans les études précliniques et cliniques de Phase 2 et de Phase 3.
En phase préclinique, PXT3003 a été évalué sur des modèles in vitro et in vivo murins de la CMT1A. Dans deux études différentes, PXT3003 a inhibé la surexpression du gène PMP22 et amélioré la myélinisation des nerfs périphériques, ainsi que les troubles moteurs et sensoriels des rats transgéniques CMT1A. Les molécules actives composant PXT3003 utilisées seules ou combinées deux par deux n'ont pas montré de résultats aussi significatifs sur les modèles in vitro et in vivo (Chumakov et al. OJRD 2014; Prukop et al. J Neurosci Res. 2020). Ces résultats prometteurs obtenus au cours des études précliniques ont conduit au lancement d'un programme de développement clinique, afin d’évaluer le bénéfice clinique potentiel et l'innocuité de PXT3003 chez les patients CMT1A.
Le profil de sécurité/innocuité, ainsi que les premières données d'efficacité de PXT3003 après 12 mois de traitement ont d'abord été obtenus lors d’une étude de Phase 2 multicentrique, randomisée, en double aveugle, contrôlée versus placebo. Celle-ci a été conduite en France sur 80 patients atteints de CMT1A légère à modérée. PXT3003 s'est avéré sûr et bien toléré aux trois doses testées. Des résultats d’efficacité encourageants et un effet-dose ont été montrés sur l'échelle ONLS (Overall Neuropathy Limitations Scale). Il s’agit d’une échelle validée mesurant le handicap fonctionnel du patient. Ces résultats ont été en faveur de la poursuite du développement clinique de PXT3003 dans un premier essai clinique de Phase 3 et ont permis de définir les paramètres de cet essai.
Le premier essai de Phase 3 a évalué de manière plus approfondie l'efficacité et l'innocuité du PXT3003. Il s’agit d’un essai international multicentrique, randomisé, en double aveugle, contre placebo, d'une durée de 15 mois. Deux doses de PXT3003 (la dose la plus élevée utilisée en Phase 2 et le double de cette dose) ont été testées contre placebo sur 323 patients atteints de CMT1A légère à modérée. Ces patients ont été recrutés dans 29 centres en Europe, aux États-Unis et au Canada à partir de décembre 2015. En raison d'un problème inattendu de formulation de la dose la plus élevée, le bras de cette dose a été arrêté prématurément en septembre 2017. Le plan d'analyse statistique a été amendé pour tenir compte du nombre élevé de données manquantes résultant de l'arrêt de traitement des patients inclus dans ce bras de l’étude. Pharnext a annoncé en octobre 2018 que l'analyse du critère principal d'évaluation, l’échelle ONLS (recommandé par la FDA et l'EMA), sur tous les groupes de patients analysés du bras de la dose élevée, suggérait une efficacité préliminaire chez l'homme. L'étude a également confirmé le profil de sécurité/innocuité de PXT3003 déjà observé précédemment.
À l’issue de cette étude de Phase 3, les patients étaient éligibles à la poursuite du traitement par PXT3003 dans le cadre d’une étude d'extension en ouvert. Les résultats ont suggéré une innocuité et une efficacité durables de PXT3003 chez les patients CMT1A après une durée totale de plus de 6 ans d’étude clinique. En décembre 2023, 120 patients étaient toujours traités par PXT3003.
Un deuxième essai de Phase 3 a été conduit pour répondre aux demandes de la FDA et l'EMA, et confirmer l'efficacité et l'innocuité du PXT3003. Cette étude, appelée PREMIER, a été un essai pivot de Phase 3 international, multicentrique, randomisé, en double aveugle, contre placebo sur une période de 15 mois. Une dose de PXT3003 (la dose élevée de la première Phase 3) a été testée contre placebo chez 387 patients atteints de CMT1A légère à modérée, dans 52 centres à l'international à partir de mars 2021. En décembre 2023, Pharnext a annoncé que l'analyse du critère principal, l'échelle ONLS qui mesure le handicap fonctionnel, n'a pas confirmé les résultats cliniques précédents. Les patients atteints de CMT1A légère à modérée ont montré des signes d'amélioration, qu'ils soient sous traitement ou sous placebo, plutôt que la dégradation lente typique de la progression naturelle de la CMT1A. D'autres données de l'essai suggèrent qu'il n'y a pas de détérioration de l'état des patients sous traitement, nécessitant une analyse plus approfondie. L'essai a réaffirmé le profil de haute sécurité du traitement, déjà établi dans les études précédentes.
Les patients sortant de l’essai PREMIER ont eu à leur tour la possibilité de poursuivre un traitement par PXT3003 dans une étude d’extension en ouvert (essai OLE-PREMIER) afin de générer des données de long terme additionnelles. En décembre 2023, 315 patients étaient toujours sous traitement par PXT3003.
