Pharnext annonce ses résultats financiers semestriels 2023 (French version only)
PARIS, France, le 31 octobre 2023 à 23h (CET) – Pharnext SCA (FR001400JXB0 – ALPHA) (la « Société »), société biopharmaceutique à un stade clinique avancé développant de nouvelles thérapies pour des maladies neurodégénératives sans solution thérapeutique satisfaisante, annonce ses résultats financiers semestriels 2023. Les principaux éléments financiers présentés sont issus des états financiers établis selon les normes IFRS, arrêtés par la Gérance et revus par le Conseil de Surveillance de la Société lors de sa réunion du 31 octobre 2023. Le rapport financier semestriel est disponible sur le site internet de Pharnext dans la section « investisseurs » (ici)
Hugo Brugière, représentant de la gérance de Pharnext, déclare : « Pharnext est à un tournant de son histoire à l’issue de ce 1er semestre et la fin d’année s’annonce très excitante. En achevant la période de traitement en double aveugle de l’essai PREMIER, notre essai pivot de Phase III de PXT3003 chez les patients atteints de la maladie de Charcot-Marie-Tooth de type 1A, selon le calendrier prévu, nous respectons scrupuleusement le calendrier annoncé et publierons les premiers résultats avant la fin de l’année. En menant à bien les négociations avec les laboratoires pharmaceutiques, nous avançons sereinement vers un accord financier majeur qui renforcera notre capacité à amener notre candidat médicament sur le marché afin d’offrir un espoir à des milliers de malades et leurs familles de trouver, enfin, une solution à un besoin médical majeur non couvert. »
FAITS MARQUANTS
Le 1er semestre 2023 a été marqué par le recentrage de la société sur son produit le plus avancé, PXT3003, avec des avancées, sur le plan scientifique et financier, au 2nd semestre 2023.
Sur le plan scientifique, Pharnext a annoncé, le 24 août 2023, la fin de l'essai PREMIER, étude clinique pivot de Phase III en double aveugle de PXT3003 dans la maladie de Charcot-Marie-Tooth de type 1A (CMT1A). Au total, 387 patients atteints de CMT1A d’intensité légère à modérée ont été inclus dans l’essai PREMIER (dépassant le nombre de 350 patients initialement défini dans le protocole). L’essai PREMIER s’étant déroulé comme initialement prévu, Pharnext est conforté dans sa capacité à mener à bien ce programme ambitieux et confirme le calendrier d’annonce des premiers résultats de cette étude au 4ème trimestre 2023.
En parallèle, Pharnext a mis en place, en janvier 2023, un comité stratégique chargé d’identifier et signer des accords de licence avec des acteurs de l’industrie pharmaceutique pour achever le développement et commercialiser PXT3003 dans la CMT1A. Ce processus a abouti, fin octobre 2023, à la réception de 3 offres émanant de laboratoires pharmaceutiques. Ces offres font ressortir une valorisation globale plancher (hors redevances indexées sur les ventes du futur médicament) estimée entre 250 et 510 M€.
Pharnext s’est engagé à communiquer sur l'avancée de cette ultime phase dans les meilleurs délais, dans le respect des engagements, notamment de confidentialité, qui pourraient être pris avec le potentiel partenaire, et rappelle que ce futur accord viendrait en complément de l’accord de licence déjà conclu en 2017, octroyant à GeneNet (Joint-Venture de recherche et développement contrôlée par Tasly Pharmaceutical et dans laquelle Pharnext détient 30%) les droits de commercialisation du PXT3003 dans la CMT1A sur le territoire chinois (Chine continentale, Hong Kong, Taiwan et Macao) et ayant déjà généré 30 M€ d’investissement de Tasly dans Pharnext.
INFORMATIONS FINANCIÈRES SYNTHÉTIQUES
Les principaux éléments financiers sont présentés dans le tableau ci-dessous. Les états financiers complets sont disponibles sur le site Internet de Pharnext : www.pharnext.com.
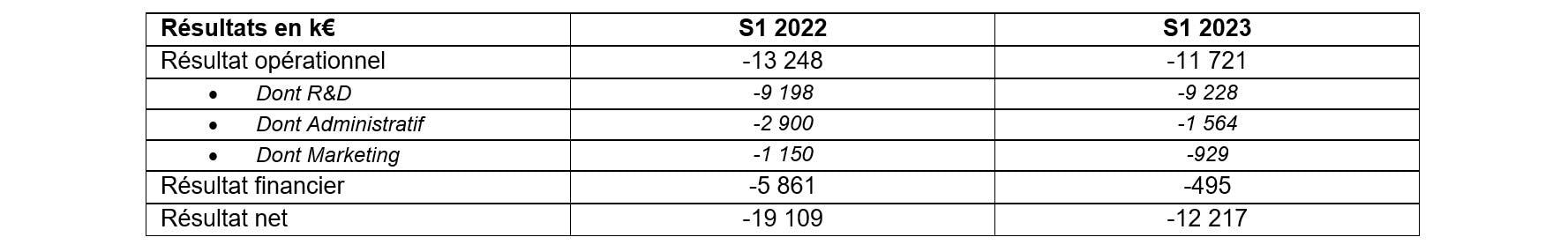
Afin de mener à bien la fin de son étude clinique de Phase III, Pharnext a maintenu son effort de Recherche et Développement, à 9,2 M€, et légèrement diminué ses dépenses de marketing, afin d’assurer la promotion de son candidat-médicament, à 929 K€. En revanche, les charges administratives ont été divisées par deux, à 1,6 M€ sous l’impulsion de la nouvelle équipe de Direction. Le résultat opérationnel ressort ainsi en amélioration sur 6 mois, à -11,7 M€.
Le résultat financier intègre un produit lié à l’abandon de créances consenti par Bpifrance sur les avances remboursables du projet DIPPAL qui a été arrêté au cours du semestre, dans le cadre du recentrage stratégique de ses activités. Ce profit vient compenser la charge comptable, sans impact sur la trésorerie, liée aux pénalités de remboursement et de conversion d’obligations en actions.
Le résultat net ressort en amélioration sensible, à -12,2 M€ à fin juin 2023.
Les contrats de financement obligataires en cours d’exécution ont permis à Pharnext de disposer de ressources financières nécessaires pour couvrir ses besoins. A fin juin 2023, l’endettement financier, composé essentiellement des emprunts obligataires, s’élève à 25,4 M€.
Comme annoncé le 30 octobre 2023, les deux partenaires financiers de Pharnext, Néovacs et Global Tech Opportunities 13, ont chacun accepté de reporter à décembre 2024 l’échéance de leurs accords respectifs de financement.
Avertissement
La société Pharnext a mis en place un financement sous forme d’OCEANE-BSA avec la société Global Tech Opportunities 13, qui, après avoir reçu les actions issues de la conversion ou de l’exercice de ces instruments, n’a pas vocation à rester actionnaire de la société.
Les actions, résultant de la conversion ou de l’exercice des titres susvisés, seront, en général, cédées dans le marché à très brefs délais, ce qui peut créer une forte pression baissière sur le cours de l’action.
Les actionnaires peuvent subir une perte de leur capital investi en raison d’une diminution significative de la valeur de l’action de la société, ainsi qu’une forte dilution en raison du grand nombre de titres émis au profit de la société Global Tech Opportunities 13.
Les investisseurs sont invités à être très vigilants avant de prendre la décision d’investir dans les titres de la société admise à la négociation qui réalise de telles opérations de financement dilutives particulièrement lorsqu’elles sont réalisées de façon successive. La société rappelle que la présente opération de financement dilutif n’est pas la première qu’elle a mise en place.
Les investisseurs sont notamment invités à prendre connaissance des risques afférents à ces opérations, mentionnés dans le communiqué ci-dessous.
À propos de Pharnext
Pharnext est une société biopharmaceutique à un stade clinique avancé, qui développe de nouvelles thérapies pour les maladies neurodégénératives actuellement sans solution thérapeutique satisfaisante. Pharnext possède un nouveau candidat médicament, PXT3003, en développement dans la maladie de Charcot-Marie-Tooth de type 1A (CMT1A), une neuropathie périphérique héréditaire, rare et invalidante. PXT3003 bénéficie du statut de médicament orphelin en Europe et aux Etats-Unis. En 2018, PXT3003 a terminé une étude clinique de Phase III, l’essai PLEO-CMT, avec des résultats préliminaires encourageants. Cet essai a été suivi d’une étude d’extension en ouvert, l’essai PLEO-CMT-FU, dans laquelle 120 patients poursuivent encore actuellement le traitement avec PXT3003. Les résultats à long terme suggèrent un bénéfice maintenu en termes de tolérance et d’efficacité, après une durée totale d’étude clinique de 6 ans. Une étude clinique pivot de Phase III internationale, l’essai PREMIER, incluant 387 patients atteints de CMT1A s’est terminé en août 2023. Les premiers résultats de l’essai PREMIER sont attendus au quatrième trimestre 2023. PXT3003 a été découvert avec l’approche R&D de Pleotherapy™. Pharnext attire l’attention des investisseurs sur les facteurs de risques, notamment financiers, détaillés dans ses rapports financiers. Plus d’information sur www.pharnext.com.
Pharnext est cotée sur le marché Euronext Growth à Paris (code ISIN : FR001400JXB0).


